
货号
产品规格
售价
备注
BN80101-10T
10T
¥2890.00
BN80101-20T
20T
¥5000.00
规 格:10T/20T
运输与保存方法:
冰袋运输。
组分 80101-1/80101-2/80101-4, -20℃保存
组分 80101-3/80101-5, 需 4℃保存
产品介绍:
百瑞极生物慢病毒包装试剂盒,对包装系统进行了优化,增加了我司特有的慢病毒出毒 增强培养基。相同的包装量,相比较实验室常规的包装体系能增加 3-10 倍的出毒量,让您 的病毒包装简单快捷,让初学者也能快速包装高滴度的慢病毒。
试剂盒的组分包含包装质粒、转染试剂、转染增强剂、慢病毒出毒增强培养基等。适用 于基因过表达和干扰慢病毒的包装,以及后续稳定细胞株的构建。
客户只需构建骨架质粒,和试剂盒中的包装质粒 Easy Mix 按 1:1 混合,用 LipoX Transfection Reagent 将混合后的质粒转染 293T 细胞,8h 就能看到荧光,48h 就能收获高滴 度的慢病毒,利用慢病毒浓缩液或者超滤柱能快速浓缩纯化病毒,为后续的感染实验提供高 纯度高滴度的病毒。
产品组分:
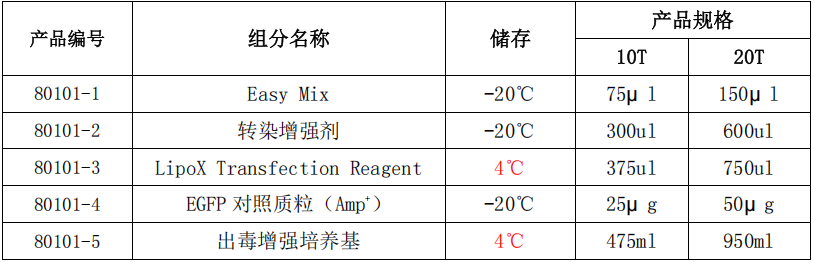
质粒准备:
慢病毒骨架质粒构建与大提:构建含目的基因或 shRNA 的骨架质粒,并进行大提获得 足够质量的无内毒素质粒,且所提质粒 DNA 的 A260/A280 在 1.8~2.0 之间,浓度大于 0.8 μg/μl。
细胞状态:选择状态良好的 293T 细胞进行病毒包装,尽量选择低代数细胞。
实验流程:
实验开始之前,在出毒增强培养基中加入 25ml 优质胎牛血清(5%血清),转染前一天 即开始使用此培养基,也可以用此培养基调整细胞状态。
1)293T 细胞准备:转染前一天,将已经状态良好的 293T 细胞以合适比例接种到 10cm 培 养皿中,当细胞长到 80%左右时准备转染;
2)转染:转染前视细胞状态和密度决定是否提前换液。取两个无酶无菌的 1.5ml EP 管,在 A、B 管中先都加入 500μl Opti-MEM,然后再分别加入质粒和转染试剂,详细内容参考表:
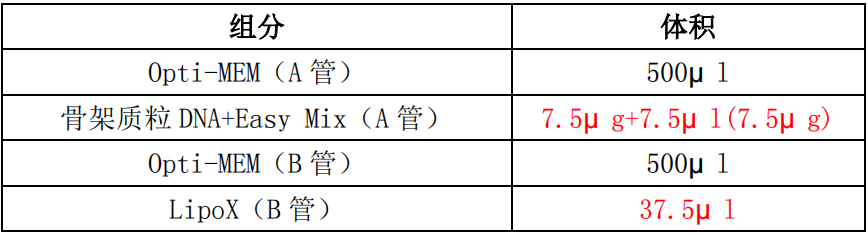
将 B 管转染试剂混合液加到 A 管中,轻轻混匀后,室温放置 15min~20min 后,再将 AB 管混合液加到细胞中摇匀然后加入转染增强剂 10ul(10ml 体积加 10ul),置于 CO2 培养箱继 续培养;
3)换液:转染过夜后,小心弃掉细胞上清(注意收集上清后需要灭菌处理),然后加入 10ml 新鲜的培养基继续培养;
4)病毒收集:换液 36-48h 后,吸取细胞上清液于 50ml 离心管,4℃保存,再重新加入 10ml 新鲜的培养基,24h 后再收集一次细胞上清于第一次的离心管中;
5)病毒处理:4℃,4000rpm 离心 10min 收集上清液,并用 0.45μm 滤器过滤后转移到新的 离心管中。对病毒进行分装保存,可以直接用于下游实验。如果对病毒的滴度及纯度有较高 要求,可用本公司的慢病毒浓缩液(BN80102)对病毒原液进行浓缩与纯化。也可以使用超 滤管超滤实现病毒的浓缩;
6)病毒浓缩:使用本公司的慢病毒浓缩液(BN80102)进行病毒的浓缩,按病毒原液的 1/4 体积加入病毒浓缩液,混匀后 4℃过夜(每 20~30min 混合一次,共进行 3-5 次)。第二天,4℃,4000rpm,离心 20min,吸弃上清后静置管子 1~2 分钟,吸走残余液体,再加入适量 的 PBS 或培养基溶解慢病毒沉淀;超滤选择 100KD 大小的超滤管,4000-6000rpm,4℃离心。
7)病毒分装与保存:将病毒原液或浓缩液按合适体积进行分装,再保存于-80℃。
注意事项
1、构建稳定细胞株时,可用病毒感染增强剂和嘌呤霉素对细胞进行感染和筛选。
2、为了您的健康,实验操作过程尽量在生物安全柜中完成,并做好个人防护,请穿实验服 和带一次性手套。所有实验废弃物均需要进行灭菌处理。
3、小量病毒包装时,也可以使用小提质粒。转染时如无 opti-MEM,可以用 PBS、生理盐水 或无血清 DMEM 代替。
4、在慢病毒包装过程中使用 opti-MEM 培养基,将出毒增强剂按照比例((10ml 体积加 300ul) 加入 opti-MEM 培养基培养细胞,会获得更好的出毒效果。